pH
| Site: | Cursos de Extensão da USP |
| Curso: | Curso CAE-AAPAV-20 |
| Livro: | pH |
| Impresso por: | Usuário visitante |
| Data: | segunda-feira, 12 mai. 2025, 08:35 |
Descrição
Esse livro tem o objetivo de fornecer subsídios teóricos para você aprender a calcular o pH de uma solução. Para tanto, vamos recordar alguns conceitos importantes: ácido de Arrhenius e concentração em mol/l.
1. ÁCIDO
Segundo Arrhenius, ácidos são substâncias capazes de aumentar a concentração de íons H+ ou H3O+ em solução. Esse fenômeno ocorre através de uma reação denominada de ionização.
Na reação de ionização, o H proveniente do ácido se liga a molécula de água para formar a espécie química H3O+ que é responsável pelo nível de acidez.
HX(aq) + H2O(l) H3O+(aq) + X-(aq)
H3O+(aq) + X-(aq)2. ENTENDENDO o pH
O pH (potencial Hidrogeniônico) está diretamente relacionado a quantidade de íons H3O+ existentes em uma solução.
Para o cálculo de pH, a concentração de íons hidrônio deve ser expressa em mol/l.
Cn = n1/V(l)
Cn= concentração em quantidade de matéria (mol/l)
n1= número de mols do soluto
V(l)= volume em litros da solução
O pH poderá ser calculado através das seguintes relações matemáticas:
pH= - log[H+]
pOH= - log [OH-]
pH +pOH= 14
Uma solução será:
Ácida: quando o pH < 7
Neutra: quando o pH=7
Básica: quando pH > 7
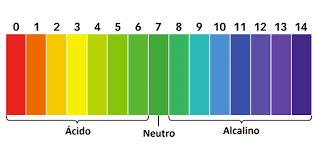
2.1 Indicadores
Os indicadores são substâncias que revelam, através da mudança de cor, o caráter ácido, básico ou neutro de um meio.
Eles são fundamentais para a análise indireta, pois auxiliam na identificação do nível de acidez, neutralidade ou alcalinidade de uma solução desconhecida.
3. CÁLCULO de pH
exemplo 1) São dissolvidos 2,52g de HNO3 em água suficiente para 4000 ml de solução. Considerando-se 100% de ionização, calcule o pH da solução e descreva a coloração que o indicador assume nestas condições.
Obs. Considere o indicador descrito no Cap. 2.1.
Dados: H=1; N=14; O=16
Resolução:
Para fins didáticos, resolveremos o exercício por etapas.
Etapa 1: Para o cálculo do pH a concentração deve ser expressa em mol/l.
Então, vamos inicialmente transformar os 2,52g de HNO3 em mols.
Para tanto, calcula-se a massa molar deste composto.
M(HNO3)= 1.(1) + 1.(14) + 3.(16)= 63 g/mol
Logo, 1 mol -------- 63 g
x -------- 2,52 g X= 2,52/63= 0,04 mol
O volume descrito no enunciado corresponde a 4000 ml, ou seja, o equivalente a 4 litros.
Portanto, Cn= n1/V(l)= 0,04 mol/ 4l = 0,01 Cn= 0,01 mol/l
Etapa 2: Como apresentado no capítulo 2 do livro, deve-se calcular o pH através da seguinte relação matemática: pH= - log[H+]
Então, pH= - log[H+]
pH= - log [0,01] pH= - log 10-2 => pH= 2
O pH é igual a 2 e o indicador passa a ter a cor amarelo-alaranjado.